イオンの応用問題④~難問は、ワンパターン問題だ!パターンで理解する中和の問題~
- atamamonjid
- 2021年9月24日
「イオンの問題が解けない」
「中和って難しい」
「中和の問題に出てくるグラフの問題が全然理解できない」
と悩んでいないでしょうか?
実は、イオンの問題は、中学校理科の最難関と言えるほど、超難しいのです。
しかも、実力テストや高校入試では頻出の問題なのです。
だから、イオンを苦手としている中学生は実に多いのです。
でも、あまり知られていない事実があります。
実は、
イオンの問題はワンパターン問題が多い
のです。
これは、以前からお伝えしている
難しい問題は、ワンパターン問題の法則
に一致するのです。
1つずつ、しっかりと理解して、ストック(知識量)を積み重ねていけば「また同じ話?あきたよ」という程度の問題です。
私は、25年以上中学生に理科を教えています。
その中で、「どうしたら中学生が少しでも理科がわかるようになるのか」について研究してきました。
そして一つの確信を得ています。
難問は良質の問題を繰り返し解くことで確実に解けるようになる
と。
この記事を読み終えるときには、イオンの問題(特に今回は“中和”の問題)をどのように解けばよいかがわかるでしょう。
今までわからなかったテスト問題が、「なるほど、こういうことだったのか」と納得できれば、大きな自信となって理科が好きになるでしょう。
この記事を読んで、「”いやになる”理科」から、「いやに”なるほど”理科」にしましょう。
本記事の内容
・イオンの単元で出てくる”中和”の問題の解き方がわかる
・イオンの増減を表すグラフの問題の考え方がわかる
それでは、詳しい説明です。
1 中和の問題を解いてみよう
最初に、中和の問題を解いてみましょう。
「中和って何?塩(えん)って何?」という人は、こちらの記事をご覧ください。
酸とアルカリの反応~酸とアルカリを混ぜるとどちらの性質も無くなる?なぜ???に答えるブログ~
それでは、問題です。
問題1 図のように、うすい塩酸8.0mLをビーカーにとり、BTB液を入れた。その後、水酸化ナトリウム水溶液をこまごめピペットで少しずつ加えていったところ、10.0mLを加えたときに緑色になった。

(1) うすい塩酸は何性か。
(2) うすい塩酸にBTB液を加えると、BTB液は何色になるか。
(3) うすい塩酸とうすい水酸化ナトリウム水溶液を混ぜたとき、どのような化学変化が起きたか。化学反応式で表しなさい。ただし、塩酸の化学式はHCl、水酸化ナトリウム水溶液の化学式はNaOHである。
(4) うすい塩酸にうすい水酸化ナトリウム水溶液を、加えていったときの、加えた水酸化ナトリウム水溶液の量とビーカー内にあるすべてのイオンの数の関係を表すグラフとして正しいものを、ア~エから1つ選びなさい。

どうでしょうか?
後半は少し難しいかもしれませんね。
でも、前半は確実に得点したいところです。
小学校の頃から「酸性・中性・アルカリ性の色の区別がわからない」という人は多いのですが、こちらの記事でしっかり覚えてしまいましょう。
酸性・アルカリ性に共通する性質~小学校のころから苦手な人が多い酸・アルカリも、語呂合わせでばっちりわかる!~
一度覚えてしまうと、楽になりますよ。
それでは解答と解説です。
【解答と解説】
(1) 酸性(塩”酸”なので酸性です)
(2) 黄色(BTB液は酸性で黄色になります。なお、アルカリ性では青色で、中性では緑色です。)
(3) HCl + NaOH → H2O + NaCl
*下に小さくつける数字が書けないので、赤字で書くことにします。
(4) エ(水素イオンは減りますが、代わりに同じ数のナトリウムイオンが増えていくので、結果的にイオンの数は変わりません。)
いかがだったでしょうか?
(4)はかなり間違えやすかったと思います。
でも、しっかり問題文を読んで考えることで正解にたどり着けるでしょう。
何事も慣れが大切です。
それでは、次の問題です。
問題2 ビーカーにうすい塩酸を10mL入れ、BTB液を数滴加えると黄色になった。この駅に、駒込ピペットでうすい水酸化ナトリウム水溶液を2mLずつ加えた。すると、10mLまで加えたときに、液は緑色になった。また、水酸化ナトリウム水溶液を12mL加えると、青色になった。次の問いに答えなさい。
(1) 加えたうすい水酸化ナトリウム水溶液が次の①~④の量になったとき、ビーカーの中で、中和反応が起こっているものを、すべて選びなさい。
① 2mL ② 8mL ③ 10mL ④ 12mL
(2) 酸性とアルカリ性を互いに打ち消しあう中和反応を、イオン式と化学式で表しなさい。。
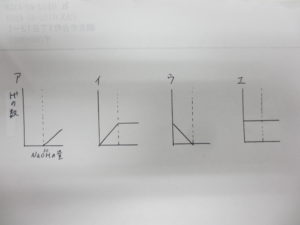
(3) 加えたうすい水酸化ナトリウム水溶液の体積と、ビーカーの中の水素イオンの数の関係を表すグラフを、①~④から選びなさい。
それでは、解いてみてください。
毎回言っていますが、必ずノートや紙に答えを書くことが大切です。
今回も、何かに書いてから解答と解説を読んでください。
それでは、解答と解説です。
【解答と解説】
(1) ① ② ③(中性になるまでは、すべて”中和”が起こっています)
(2) H+ + OH– → H2O
*上につける数字や文字は青字で書いてあります。
(3) ウ(今回の問題は”水素イオンの数”を聞かれています。水素イオンは中和することで減っていきます。また、中性になった後は0個になります。)
特に(3)の問題の問題文に注意です。
問題1の(4)との違いに注意しましょう。
それでは、次の問題です。
問題3 次のような実験を行った。
【実験】
① うすい水酸化ナトリウム水溶液を用意し、4個のビーカーA~Dにそれぞれ10mLずつとった後、BTB液を数滴ずつ加えた。次に、うすい塩酸を用意し、ビーカーB~Dにそれぞれ、4,8,12mLずつ加えて水溶液の色の変化を観察した。表は、その結果をまとめたものであり、ビーカーCの水溶液のpHを調べると7であった。
② ビーカーCno水溶液の一部を蒸発皿にとり、水分がなくなるまで加熱した。加熱後、蒸発皿には白色の物質が残った。

(1) 次の文の①②に当てはまる言葉をそれぞれ書きなさい。
酸性の水溶液の水素イオンとアルカリ性の水溶液の水酸化物イオンが結びついて、( ① )ができ、たがいの性質を打ち消しあう反応を( ② )という。
(2) ①のビーカーA~Dのうち、水溶液中に存在する水酸化物イオンの数が最も多いのはどれか。
(3) ①で使用したうすい水酸化ナトリウム水溶液2mLをビーカーDの水溶液に加えた。この水溶液を中性にするためには、①で使用したうすい塩酸、うすい水酸化ナトリウムのどちらを何mL加えるとよいか。
(4) ②で残った白色の物質の化学式を書きなさい。
これまでとは若干傾向が変わっています。
それに注意して、やってみましょう。
【解答と解説】
(1) ① 水 ② 中和
(2) A(中和が起こっていない水酸化ナトリウム水溶液が一番水酸化物イオンが多いです。)
(3) うすい水酸化ナトリウム水溶液を3cm3(Dは、HClが4cm3多いので、水酸化ナトリウムは5cm3多い。そのうち、2cm3入れたので、残りは5-2=3cm3となる。)
(4) NaCl(塩酸と水酸化ナトリウムの中和は「HCl + NaOH →H2O + NaCl」なのでNaClができる)
今日は、難しい問題が多かったので、疲れた人もいるかと思います。
次が最後の問題なので、がんばりましょう。
問題4 次の実験について、問いに答えなさい。
【実験】
① ビーカーにうすい塩酸10mLをとり、そこにBTB液を数滴加えると、水溶液は黄色になった。
② 図のように、①の水溶液に、うすい水酸化ナトリウム水溶液を2mLずつガラス棒でかき混ぜながら加えると、8mL加えたときに水溶液は緑色になった。
③ 緑色になった水溶液をスライドガラスに1滴とり、乾燥させると白い結晶が得られた。
④ ②で緑色になった水溶液に、さらにうすい水酸化ナトリウム水溶液を加えていくと、水溶液は青色になった。

(1) うすい水酸化ナトリウム水溶液を加えるためにつかった、図のXの器具を何というか。
(2) (1)の器具Xの使い方として、適切ではないものをア~エから選びなさい。
ア 図のように、下の3本の指でガラスの部分をもつ。
イ 親指と人差し指でゴム球を押してから、器具Xの先を測り取りたい液体の中に入れる。
ウ 親指をゆるめて液体を吸い込んでから、液体をこぼさないように器具Xの先を上に向ける
エ 親指でゴム球を押して、必要な量の液体を出す。
(3) 加えたうすい水酸化ナトリウム水溶液の体積と、混合液中の水素イオンの数、水酸化物イオンの数の関係を表すグラフとして適切なものをア~エから、それぞれ選びなさい。
【解答と解説】
(1) こまごめピペット
(2) ウ(ゴム球をぬらしてはいけないので、上に向けてはいけません)
(3) 水素イオン・・・イ(最初に塩酸が入っていて、中和により減っていく)
水酸化物イオン・・・ウ(最初は中和によって増えないけれど、中性以降は増えていく)
今回は、「中和でグラフが出てくる問題」を中心に解いていきました。
この問題は難しくて、苦手な人が多いです。
言い換えると、
これが解ければ差がつく問題
です。
ライバルに差をつけるためにも、繰り返し解いて、コツをつかみましょう。
